超过90%的肝细胞癌(HCC)病例在纤维化或肝硬化的情况下发展,由于癌症相关成纤维细胞 (CAF)和癌症干细胞(CSC)之间错综复杂的相互作用,HCC 的肿瘤微环境(TME)与众不同,它们共同调节HCC的进展。然而,CSC在HCC发展过程中协调肿瘤基质动力学的机制仍然难以捉摸。
2024年7月3日,南京医科大学张业伟团队在Signal Transduction and Targeted Therapy发表题为“Semaphorin 3C (Sema3C) reshapes stromal microenvironment to promote hepatocellular carcinoma progression”的研究论文,研究揭示了Sema3C在纤维化肝脏、HCC组织、HCC患者外周血以及索拉非尼耐药组织和细胞中的显著上调,其过表达与 HCC 干性特性的获得相关。该研究进一步确定 NRP1和ITGB1 是 Sema3C 的关键功能受体,激活下游AKT/Gli1/c-Myc信号通路以增强HCC自我更新和肿瘤起始。
HCC 细胞来源的Sema3C促进体内细胞外基质(ECM)收缩和胶原沉积,同时还促进肝星状细胞(HSC)的增殖和活化。从机制上讲,Sema3C与HSC中的NRP1和ITGB1相互作用,激活下游 NF-kB 信号传导,从而刺激 IL-6 的释放并上调 HMGCR 表达,从而增强 HSC 中的胆固醇合成。此外,CAF 分泌的 TGF-β1 激活 AP1 信号转导以增强 HCC 细胞中 Sema3C 的表达,从而建立加速 HCC 进展的正反馈回路。总之,研究结果突出了Sema3C作为一种新的生物标志物,在肝癌发生过程中促进CSCs和基质之间的相互作用,从而为提高HCC的治疗效果和克服耐药性提供了一条有希望的途径。

肝细胞癌(HCC)最常见的恶性肿瘤,预后不良,具有独特的癌前环境(PME),其特点是超过 90% 的病例由纤维化或肝硬化引起。肝星状细胞(HSC)于Disse 的内皮下空间,位于肝窦内皮细胞和肝细胞之间,在肝生理学和纤维化中起着至关重要的作用。在慢性肝损伤期间,静止的造血干细胞经历反式分化为活化的增殖性肌成纤维细胞,肌成纤维细胞是细胞外基质(ECM)成分的主要来源。造血干细胞是肿瘤微环境中细胞成分的一部分。最近的一项研究表明,纤维化肝脏中存在两种不同的造血干细胞亚群,肌成纤维细胞造血干细胞 (myHSC)促进肝癌发生,而表达细胞因子和生长因子的造血干细胞 (cyHSC)抑制肝癌。
myHSC 和 cyHSC 之间的不平衡导致HCC发展的风险增加,并且这种不平衡在空间上局限于特定区域。在 HCC 区域,作为 HCC 基质微环境的主要细胞成分,癌症相关成纤维细胞 (CAF)被认为起源于 HSC。CAFs通过直接刺激肿瘤细胞增殖、促进血管生成和重塑微环境来支持肿瘤发生。此外,肿瘤内CAF的空间分布可能会显着影响肿瘤的进展。研究表明,与肿瘤细胞直接接触的 CAF 会激活 TGFβ 信号传导和胶原沉积,而远离肿瘤的 CAF 会促进透明质酸沉积,并通过分泌 IL-6 和其他炎症介质来重塑 TME。此外,新出现的证据表明,CAF主要通过破坏肿瘤细胞内的药物递送和生化信号传导来促进化疗耐药性。然而,TME加剧myHSCs和cyHSCs之间的不平衡并促进HSCs向CAFs转化的机制尚不清楚。
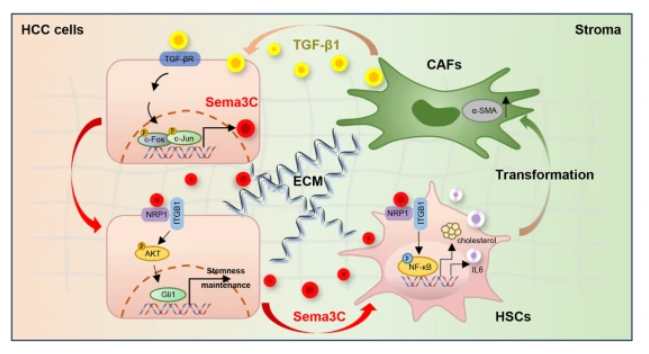
Sema3C介导HCC中CSCs与基质之间的相互作用(图源自Signal Transduction and Targeted Therapy )
癌症干细胞(CSCs)作为肿瘤细胞的一个独特亚群,具有自我更新和分化成其他细胞类型的能力。这些特性使CSC能够抵抗化疗,从而促进肿瘤复发。许多细胞表面蛋白已被鉴定为 HCC 的CSC标志物。CSC中表达的大多数生物标志物不具有特异性,也可以在正常胚胎干细胞或正常组织中表达。此外,CSCs受多种信号通路的调节,以维持其自我更新能力。CSCs的自我更新维持也依赖于基质微环境的支持,越来越多的证据表明,CAFs通过分泌蛋白质或细胞外囊泡来维持CSCs的特性。CSC还可以在生态位内招募或刺激基质细胞,以重塑更具支持性的TME。然而,目前关于肝细胞癌中CSC对CAFs调控的研究较少。
为了阐明肿瘤基质和CSC之间相互作用在 HCC 肿瘤发生中的作用,研究鉴定了Sema3C是纤维化和 HCC 组织中高度上调的蛋白质,Sema3C 作为迁移皮质轴突的轴突引诱剂,促进人多巴胺能神经元的轴突生长,将运动神经元引导至特定靶标。先前的一项研究表明,上调的 Sema3C 与 HCC 的肿瘤大小和不良预后显着相关。然而,Sema3C在HCC中上调的潜在机制以及它是否与TME的重塑有关仍不清楚。
最后,研究发现Sema3C以自分泌方式促进HCC的干性维持。此外,Sema3C重塑ECM,并通过旁分泌方式促进HSCs的激活和向CAFs的恶性转化。反过来,TME定位的CAF通过分泌TGF-β1刺激Sema3C表达。因此,Sema3C可能作为介导CSCs与肿瘤基质之间通讯的关键生物标志物,在HCC的发展中形成恶性循环。
参考消息:
https://doi.org/10.1038/s41392-024-01887-0
读书报告 | 信迪利单抗辅助治疗高危肝细胞癌的II期临床研究
![]() 0
2024-06-22
点击查看
0
2024-06-22
点击查看

Biomed Pharmacother:石斛活性成分Dendrobin A通过抑制NF-κB信号传导抑制肝细胞癌
![]() 0
2024-06-25
点击查看
0
2024-06-25
点击查看

Nat Commun:中国科学技术大学刘连新团队合作剪接体核心成分在肝细胞癌进展中起重要作用
![]() 0
2024-06-24
点击查看
0
2024-06-24
点击查看

WJG:中国学者研究---预测肝细胞癌肝移植预后的列线图
![]() 0
2024-06-28
点击查看
0
2024-06-28
点击查看
WJG:GALAD评分在肝细胞癌分期和1年死亡率中的诊断和预后性能
![]() 0
2024-06-28
点击查看
0
2024-06-28
点击查看
European Radiology:基于弥散加权成像的肝细胞癌微血管浸润的术前预测
![]() 0
2024-07-07
点击查看
0
2024-07-07
点击查看
