综 述
多灶性/多中心性乳腺癌(MMBC)是指发生在同侧乳房的2个及以上乳腺恶性肿瘤,是乳腺癌中较少见的一种类型,具有独特的影像学、病理学特性。传统观念认为,相较于单灶性乳腺癌(UBC),MMBC的局部复发(LR)风险更高,整体生存预后更差,不宜行保乳手术。近年来针对MMBC的研究愈发深入,使得临床医生在诊治MMBC方面积累了更多经验,推动其诊断和治疗方式向循证化、个体化、精准化发展。本文围绕MMBC流行病学特征、术前影像学评估、病理异质性与分子标志物、手术方式等方面展开论述,以期帮助临床医师快速了解该领域的最新进展,并为临床进行MMBC诊治提供参考意见。
1 MMBC定义与流行病学特征
1.1 MMBC定义
MMBC被用于描述在同一侧乳房发生的2个或2个以上的恶性肿瘤,每个肿瘤在物理状态上存在确切的分隔。MMBC最常用的定义如下:从解剖学角度出发,多灶性乳腺癌(MFBC)是指单侧乳腺的同一象限内存在2个或多个恶性病灶,病灶可能为同源;多中心性乳腺癌(MCBC)则是指在单侧乳腺的不同象限内发生2个或多个恶性病灶,肿瘤病灶可能为不同起源[1]。
一般认为,MMBC的多个病灶中,至少有1个为浸润性乳腺癌,其他病灶可为导管原位癌(DCIS)或浸润性癌。此外,一些研究也使用病灶间距定义MMBC,认为MFBC病灶间距小于某临界值,而MCBC病灶间距超过该值,这一数值为20~50 mm不等[2-3]。由于缺乏统一定义,且出于研究便利性考虑,MFBC、MCBC常被统一归为MMBC进行整体研究。
1.2 MMBC流行病学特征
相较于UBC,MMBC在临床上较为少见。在涉及同侧乳腺多个病变的研究中,早期文献存在MFBC和MCBC两个术语被混用或混淆的问题,一定程度上导致报告发病率失真[4]。
2014年,Vera-Badillo等[5]在一项纳入24篇研究共67 557名女性的Meta分析中报告,MMBC发病率为9.5%。近年来,随着成像技术精度的提升,MMBC检出率呈上升趋势,近期文献中报道的MMBC发病率分布于4%~60%[6-7]。提示MMBC实际发病率可能比既往认知中的更高,且随着影像学和病理学技术的进步,MMBC检出能力将会进一步提升,其发病率可能较早期研究中的数据明显升高。
2 MMBC术前影像学评估
由于起病隐匿,MMBC病程初期可能无明显特异性临床特征,因此早期诊断高度依赖于影像学检查。高质量的影像学检查可在术前发现乳腺多病灶的存在,从而在MMBC个体化治疗策略的制定过程中发挥关键作用,因此,在发现有手术指征的乳腺病灶后,采用适当的影像学检查是实现精准诊疗的重要途径。MMBC常用的3种影像学技术包括乳腺X线检查、超声和MRI。
2.1 乳腺X线检查
乳腺X线摄影(MG)也称乳腺钼靶检查,通常特指在临床广泛应用的全视野数字乳腺X线摄影(FFDM)。MG是乳腺疾病筛查和乳腺癌诊断的常规方法,可探测乳腺组织病变情况,并为良恶性结节性质的判定提供参考信息,但其在致密型乳房中检测癌灶的能力受限。文献显示,MG在脂肪型乳房中检出MMBC的灵敏度可高达100%,而在腺体纤维型或致密型乳房中仅为45.5%[8]。
近年来随着医疗新技术的发展,新兴的乳腺X线检查手段如数字化乳腺断层摄影(DBT)、对比增强光谱乳腺X线摄影(CESM)逐渐应用于临床,并在一定程度上提高了MMBC检出率。
DBT是一种基于传统二维MG开发的X线三维断层成像技术,可从不同角度重复曝光乳腺后经软件生成重建图像,有助于识别乳腺隐匿病变。Lameijer等[9]分析发现,在对MG筛查患者进行召回复核时,近半数额外发现的同侧乳房恶性病变为通过MG联合DBT而检出。研究显示,虽然DBT识别MMBC的灵敏度仍不如MRI,但与MG相比,已有显著提升[10-12]。
CESM通过使用螯合碘基X线造影剂显示肿瘤新生血管情况,可提高MMBC的检出率和诊断准确率。Lorek等[13]基于999例行手术治疗的乳腺癌患者临床资料,评定了CESM在MMBC识别中的应用价值,结果显示CESM检测MMBC的特异度与MG相当(94.90%比99.01%),灵敏度显著高于MG(87.63%比38.51%)。Lee等[14]研究认为,与MRI相比,CESM在MMBC的诊断中具有更高的特异度和阳性预测值,且成本更低、检测速度更快,具有良好的应用前景。
2.2 超声
超声是诊断乳腺疾病不可或缺的工具,对于我国女性而言尤为重要。相较于白种女性群体,我国女性中致密腺体型乳腺的占比显著升高,其乳房中致密组织所占比例比白种女性高出20%[15],而致密腺体型相比MG更适合行超声筛查[16]。
Rehman等[17]报道显示,超声鉴别诊断乳腺癌卫星肿块良恶性的灵敏度、特异度分别为88.2%、73.6%,提示其可为MMBC的术前诊断提供重要参考信息。
此外,超声对隐匿性乳腺肿瘤具有较高的敏感性,可作为MG的有效补充。Moon等[18]研究发现,除MG检测结果外,超声在201例疑似乳腺癌患者中额外发现了5%的MFBC和9%的MCBC。但有研究者持不同观点,其研究数据表明,仅使用乳腺X线检查和超声进行MMBC术前诊断的灵敏度仅为50.8%,可导致近50%的病例漏诊[19]。
自动乳腺容积超声成像(ABUS)是一种新兴的高分辨率三维超声技术,可自动扫描覆盖全乳腺的多层次结构,还可同屏对比左右两侧乳腺,克服了传统超声成像面积小、对操作者经验依赖性高等缺点,或可进一步提高MMBC的检出率。
Helal等[20]在一项纳入562例乳腺癌患者的研究显示,ABUS在评估MMBC方面显示出良好的诊断一致性(Kappa值为0.64),识别MMBC的灵敏度、特异度分别为84%和80.6%,明显优于MG与传统超声联合应用(灵敏度:32.1%,特异度:67.6%)。
2.3 MRI
MRI已成为乳腺癌患者术前辅助评估的重要手段[21]。对于MMBC患者而言,是否常规进行MRI尚存争议,这是由于该检查对良恶性病变的鉴别能力有待提升,其高灵敏度、低特异度的特点可能导致更多的良性病灶被检出,进而使患者承受非必要的手术创伤。
一项Meta分析显示,0.8%~11.1%的MMBC假阳性患者由于MRI诊断而接受了乳房全切等更大范围的手术[22]。动态增强磁共振扫描 (DCE-MRI) 联合弥散加权成像(DWI) 有望解决上述问题。DCE-MRI是最灵敏的乳腺癌影像诊断技术,可连续监测病灶对造影剂的摄取情况,在MMBC检出方面具有比MG、超声更高的灵敏度(96.6%~100%)[11,23]。
DWI则通过计算表观弥散系数,可定性分析病灶的结构和成分,二者联合应用可提高诊断MMBC的准确率。报道显示,相较于单一DCE-MRI,DWI与DCE-MRI联合应用诊断MMBC在保持较高灵敏度的同时,还可提高检测的特异度(MFBC:78.5%比21.4%;MCBC:60.8%比17.3%)和总体准确率(MFBC:87.8%比83.3%;MCBC:73.1% 比51.2%)[24]。
对于拟行保乳手术的乳腺恶性肿瘤,术前避免对多病灶的漏诊尤为重要。目前,临床常规联合应用超声和MG进行乳腺病灶检测,必要时引入MRI,以期通过多种手段实现MMBC的精准识别,但仍存在无法完全检出MMBC病灶的风险。
虽然MG、超声、MRI设备经过不断迭代,MMBC检出率大为提升,但单一影像学手段仍无法兼备满意的灵敏度和特异度,而随着ABUS、DCE-MRI、DWI等新兴技术的应用,相信可为MMBC的临床诊断提供更多机遇。
3 MMBC病理异质性与生物标志物
3.1 MMBC病理异质性
约24%~29.2%的MMBC患者在不同病灶间具有病理类型、组织学分级、免疫组化与分子亚型等方面的异质性[25-27]。对于MMBC而言,通常认为多个病灶中经病理证实的最大浸润性肿瘤灶为主要病灶,原位癌、大小次之的浸润性肿瘤则为次要病灶。
Tong等[28]对121例MMBC患者研究发现,12例(9.9%)患者的多个病灶间病理类型不同,其中10例患者的主要病灶为浸润性导管癌,次要病灶为导管原位癌;5例患者(4.1%)的主要病灶与次要病灶组织学分级不同。Janeva等[25]报道,雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2 (HER2)和Ki-67增殖指数在MMBC多灶间的异质率分别为2.7%、19.1%、7.7%和16.9%,灶间分子亚型不一致率为26.7%,其中37.5%为次要病灶,其较主要病灶更富侵袭性,最常见的分型组合为luminal A/luminal B HER2-(主要病灶/次要病灶)。
以上研究表明,MMBC的多个病灶间普遍存在一定的病理异质性,在当下仅以主要病灶特征指导MMBC治疗的临床背景下,可能对疗效产生重大影响,值得临床关注。
灶间病理异质性可导致次要病灶对针对主要病灶的治疗策略反应不敏感,或由于灶间异质性未被发现致使治疗不足,因此具有灶间病理异质性的MMBC或与更差的生存预后相关。
Li等[27]根据多病灶之间的ER、PR、HER2和Ki-67状态将MMBC患者分成同质组和异质组,中位随访时间35个月时,与同质组相比,异质组无病生存率(81.2%比96.5%, P=0.041) 和总生存率(95.8%比99.5%, P=0.059) 明显更差。目前,多学科诊疗(MDT)对MMBC灶间病理异质性的主要应对方式为升级治疗。
Buggi等[29]针对113例浸润性MMBC患者的研究中,1.8%患者主要病灶ER阴性,而次要病灶ER阳性,临床予以内分泌治疗;2.6%的患者主要病灶ER阳性,而次要病灶ER阴性,此部分患者在内分泌治疗的基础上额外进行了辅助化疗。对于HER2与Ki-67增殖指数存在灶间差异的患者,同样需进行升级治疗,临床可根据具体亚型予以针对性干预[25]。
此外,MMBC多病灶间可能具有不同的基因检测结果,并进而影响治疗决策。既往研究显示,对存在灶间异质性的MMBC患者行Oncotype Dx检测后发现,27%(6/22)的患者灶间复发评分差异显著,建议此部分患者实施辅助化疗[30]。上述证据表明,MMBC灶间病理异质性值得被纳入治疗考量体系之中,尤其对于激素受体及HER2表达不一致的MMBC,适当升级治疗或可提升治疗效果。
3.2 MMBC特异生物标志物
传统生物标志物如ER、PR、HER2已广泛用于指导乳腺癌治疗策略,目前尚缺乏针对MMBC的特异性生物标志物。MMBC与UBC间的差异基因与蛋白可能提示多发性疾病的独特特征。
Lang等[31]使用基因芯片对MMBC患者和UBC患者标本中的差异表达基因进行筛选,并采用RT-PCR法证实MMBC样本中ABCB 5基因表达水平显著下调,ABCC 11基因显著上调,二者分别与上皮-间质转化、肿瘤耐药有关,可能参与了MMBC的发生和疾病进展。该研究团队亦报道了MMBC患者和UBC患者标本中具有差异表达的4种长链非编码RNA(分别为C19orf33、C3orf52、C15orf48和C4orf19),为MMBC分子标志物的筛选提供了新思路[32]。
在预后生物标志物方面,Zehni等[33]观察到甲状腺激素受体 (THR)等核激素受体与UBC和MMBC具有不同的关联性:UBC组中THRα1阳性与更差的无病生存期(DFS)相关,而MMBC组中THRα2阳性却与更满意的DFS相关,提示THR有望作为MMBC预后的潜在预测因子。该研究团队既往发现维生素D受体 (VDR)高表达是MMBC患者总生存期(OS)的独立危险因素,对于MMBC的预后具有提示作用[34]。
上述文献为筛选MMBC相关生物标志物提供了初步证据,但仍需进一步明确各分子指标与MMBC的独特相关性,并在临床试验层面验证其应用价值,以期为早期识别临床和影像学隐匿性的MMBC及其预后转归提供有益指导。
4 MMBC外科治疗
4.1 目前可选手术方式
对于MMBC这一特殊类型的乳腺癌,既往认为其比UBC具有更高的侵袭性和更差的临床预后,由于保乳手术会增加其LR风险,因此将其视作保乳手术的禁忌证,并推荐采用全乳切除术进行治疗。近年来,随着外科手术的精进、综合治疗手段的多元化发展,以及由于发病群体呈年轻化趋势所致保乳需求增加,MMBC行保乳治疗成为该领域研究热点及发展趋势。
保乳手术的传统术式包括肿瘤局部广泛切除、乳房象限切除等,而肿瘤整形术 (oncoplasty)是一种更为追求美学效果的新兴保乳术式,其将肿瘤外科和整形手术相结合,使用容量移位等技术可同时实现肿瘤切除与外观重塑,有望成为MMBC患者的新选择。
4.2 MMBC行保乳手术的可行性
4.2.1 当前证据和学界态度
目前,MMBC保乳相关证据主要集中于近30年间的队列研究、病例对照研究、病例报告、系统综述与Meta分析、指南与共识,由于多中心随机对照研究MIAMI试验尚未公布结果,因此尚缺乏来自随机对照试验的研究证据(图1)。
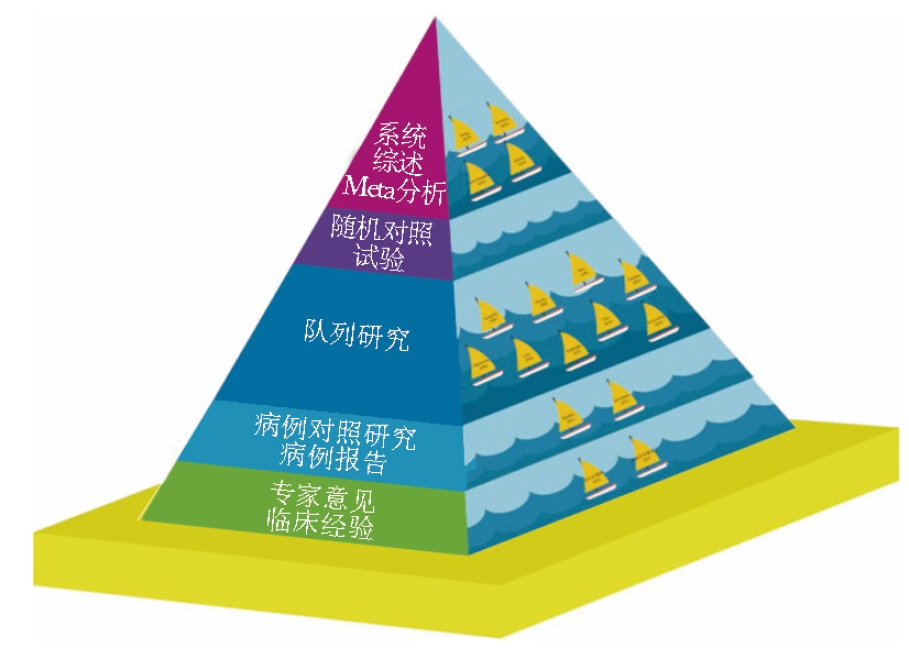
图1 MMBC保乳手术证据等级金字塔
MMBC(multifocal/multicentric breast cancer):多灶性/多中心性乳腺癌
Houvenaeghel等[35]和Patani等[36]综述了MMBC相关文献结果,积极支持保乳手术治疗。Fang等[37]和Winters等[2]对相关文献进行Meta分析后发现,MMBC患者行保乳手术治疗的LR率与全乳切除术无显著差异,虽然该结论受纳入文献缺乏高质量前瞻性研究的掣肘,但仍初步提示,经过评估的MMBC患者行保乳手术具有可行性。队列研究多为回顾性,详细结果将于下一小节进行论述。
来自病例对照研究和病例报告的证据较少,且研究结果不一:2015年Shaikh等[38]在一项纳入110例MMBC患者和263例与之相匹配的UBC患者的研究中发现,MMBC患者无论是行保乳手术还是全乳切除术,其LR率均高于同种术式的UBC患者,其认为MMBC需在手术的基础上予以放疗、内分泌治疗等其他综合治疗。Silverstein等[39]则报告了2例成功完成极端肿瘤整形保乳术 (EOBCS) 的MMBC案例,认为该术式具有良好的应用前景。
近年来,专家意见和临床经验亦逐渐趋向于保乳手术。2017年圣加仑会议专家小组对MMBC保乳治疗持鲜明的赞成态度,认为只要达成美观效果、切缘阴性并辅以放疗即可行保乳手术[40]。
2022年美国国立综合癌症网络(NCCN)指南[41]不再将MMBC视为保乳手术的相对禁忌证。综合而言,适当条件下MMBC患者行保乳手术是安全可行的,但病例应经过严格的评估与筛选。期待该观点经前瞻性随机对照试验予以进一步论证。
4.2.2 MMBC保乳手术的安全性
1994年发表的一项单臂研究[42]报道了1977—1989年间接受保乳手术和辅助治疗的27例MMBC患者的治疗效果,中位随访53个月时仅1例(3.7%)出现LR。2009年Gentilini 等[43]在单臂研究中回顾了保乳手术的应用价值,结果显示476例MMBC患者的5年累积LR率为5.1%。上述两项研究提示MMBC患者接受保乳治疗在肿瘤学意义上可能是安全的。
为进一步验证MMBC保乳手术的安全性,对比研究从两个方面着手,即MMBC与UBC保乳手术的预后差异、MMBC保乳治疗与全乳切除术的预后差异。早期的系列报道认为,相较于UBC,MMBC行保乳手术的复发风险更高:
1989年Leopold等[44]比较了10例MMBC患者与707例UBC患者接受保乳手术及放疗的疗效,发现MMBC患者的LR率高于UBC患者(40%比11%)。1990年Kurtz等[45]对接受保乳手术和放疗的586例单侧Ⅰ~Ⅱ期乳腺癌患者中位随访71个月后发现,15例(25%) MMBC患者和56例(11%) UBC患者出现LR,其建议MMBC患者应谨慎行保乳手术。但该两项研究发表于保乳手术尚未成熟的年代,且存在样本量较小/未妥善管理肿瘤切缘的局限性。
随着临床对保乳治疗认知的进一步深入,肿瘤切缘管理逐步得到重视。2004年Okumura等[46]仅对保乳切缘与肿瘤组织距离较近(≤5 mm) 或切缘阳性患者给予瘤床加强放疗,中位随访58个月时,MMBC组与UBC组LR率无统计学差异。在保乳手术体系日渐规范后,保乳手术切缘阳性病例通常需进行再切除或改行全乳切除术。在此标准下,2009年Lim等[47]对接受保乳治疗的0~Ⅱ期MFBC患者与UBC患者进行长期随访(中位随访时间59个月),结果显示二者的LR率亦无统计学差异(2.0%比1.3%)。
2016年Tan等[48]纳入40例MMBC和120例UBC患者,其中34例(85%)MMBC患者和103例(85.7 %)UBC患者接受了保乳手术,中位随访55个月时UBC组LR率为3%,而MMBC组无LR病例。综合上述数据可知,相较于UBC患者,MMBC患者接受规范的保乳手术并无局部控制不良的确凿证据。
另一方面,相较于全乳切除术,MMBC患者行保乳手术的安全性如何?1999年的一项回顾性研究[49]比较了56例行保乳手术的MFBC患者与132例行全乳切除术MFBC患者的临床预后,发现二者5年总生存率、LR率均无统计学差异。Kaplan等[50]在一项纳入55例MMBC患者的研究中发现,保乳手术和全乳切除术具有相似的LR率和无远处转移生存期。Kadioglu等[51]、Lim等[47]亦得出类似结论,即未发现MMBC患者的LR风险在保乳手术和全乳切除术间存有差异,甚至行保乳手术者的OS更理想。但上述研究纳入的MMBC病例主要为MFBC,尚缺乏MCBC患者的可参考信息,故保乳手术治疗MCBC的安全性尚需积累更多数据予以验证。
近10年来,肿瘤整形术在MMBC保乳手术实践中得到了广泛认可,尤其是EOBCS可进一步挽救传统观念上需通过全乳切除术治疗的MMBC。EOBCS是指对大多数医生认为需行全乳切除术的乳腺癌患者(MMBC或肿瘤直径>50 mm)使用肿瘤整形技术、避免使用假体的保乳手术。
2019年Crown等[52]在一项纳入111例接受EOBCS的患者(其中MMBC患者82例)队列研究中发现,中位随访36个月时,完成EOBCS和辅助放疗的患者中LR率仅为1.1%,且未发现任何区域/远处复发。2021年Savioli等[53]报道了EOBCS治疗MMBC及大型UBC的随访数据,5年无病生存率为91.5%,且MMBC患者未出现复发。
欧洲肿瘤研究所于2022年发表的最新证据[54]进一步论证了肿瘤整形术的安全性:将100例接受肿瘤整形术和100例接受全乳切除术的MMBC患者按肿瘤直径、淋巴结转移状态、组织学分级等指标进行匹配,肿瘤整形术全组和50%的全乳切除术患者接受了辅助放疗,随访显示两组10年LR、区域复发、远处复发情况以及DFS、OS均无统计学差异。
上述结果表明,MMBC保乳治疗的临床结局与全乳切除术相比无显著劣势。虽然早期文献显示,MMBC行保乳手术具有较高的LR风险,但随着医疗水平的进步,近20年的研究则多数认为MMBC选择保乳手术治疗不会对生存时间与局部控制情况产生不利影响,奠定了当前对MMBC进一步尝试保乳治疗的证据基础。相关文献虽多为回顾性研究,不可避免地受选择偏倚的影响,但最新公布的前瞻性试验进一步提升了支持MMBC保乳治疗的证据质量。
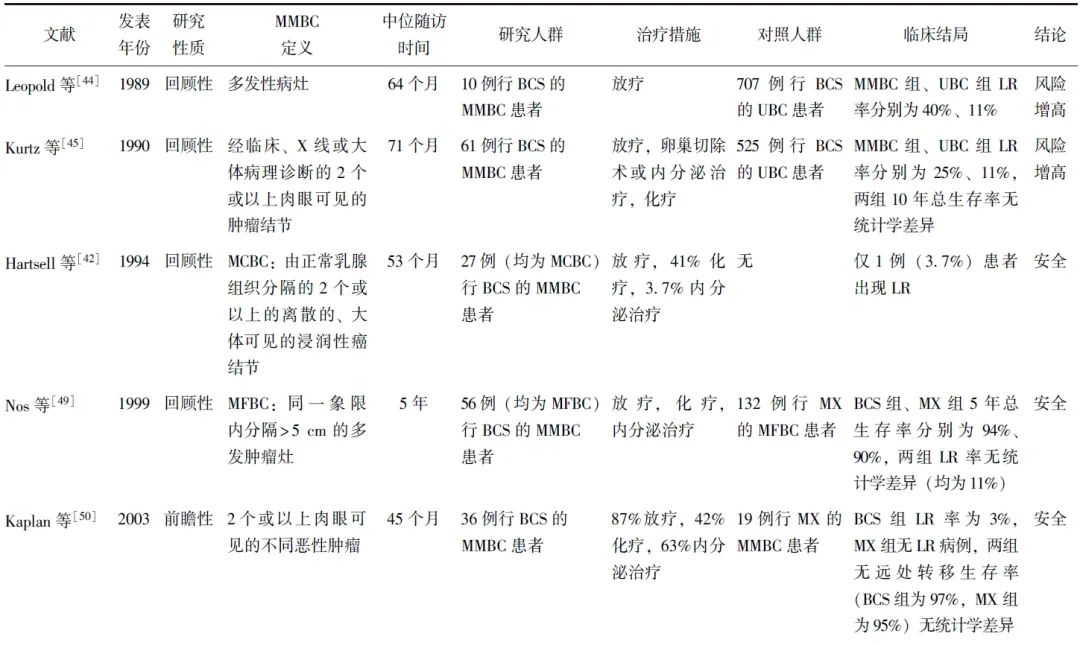
备受瞩目的前瞻性临床试验ACOSOG Z11102于2023年公布了最新结果[55]:中位随访66.4个月时,接受保乳手术及术后全乳放疗、瘤床增强的204例MMBC患者中仅6例出现LR,估计的5年累积LR率为3.1%,满足临床可接受标准(5年累积LR率<8%);探索性分析提示,术前接受MRI检查患者的5年LR率仅为1.7%,显著低于未行MRI者(22.6%),进一步说明经过充分评估的MMBC患者行保乳手术可取得满意疗效。部分评估MMBC保乳手术安全性的研究见表1。
表1 评估MMBC保乳手术安全性的部分研究


4.2.3 MMBC保乳手术的局限性
切缘情况是制约MMBC保乳手术成功与否的一大因素。早期研究中,MMBC保乳手术患者具有较高的LR率被认为与切缘状态不明或阳性有关[44-45]。Okumura等[46]研究认为,若MMBC保乳手术在镜下切缘为阴性,则可实现良好的局部控制。
Kaplan等[50]的研究中虽报告MMBC保乳手术与全乳切除术患者具有相似的预后,但其中56%的保乳手术患者接受了至少1次的再切除手术以获得阴性切缘,提示切缘阴性是保障MMBC保乳手术疗效的关键,且在技术层面上实现切缘阴性具有一定难度。除广泛微钙化等不适宜接受保乳手术的情况外,存在DCIS的MMBC病例切缘阳性风险较高,术前决策时需慎重评估。
目前,MMBC保乳手术的切缘宽度尚未达成共识。2014年以来,“no ink on tumor”(墨染切缘处无肿瘤)被认为是浸润性癌应采取的恰当切缘及切缘阴性标准。2017年圣加仑会议专家小组亦推荐MMBC保乳手术遵循此原则。
Lim等[47]报告了1例较特殊的MMBC病例,其1处DCIS病灶的5个切缘中有1个距肿瘤小于1 mm,尊患者意愿未行再切除手术,仅接受术后化疗、放疗和内分泌治疗,随访60个月时未见肿瘤复发,研究者认为虽然受累的切缘是MMBC出现LR的危险因素,但通过放疗或可消除微小残留肿瘤。
但2022年BMJ发表的一篇Meta分析却不支持此结论[56]。该研究发现,相较于阴性切缘(距肿瘤≥2 mm),接近切缘(距肿瘤<2 mm)与浸润性乳腺癌保乳手术的远处复发(HR=1.38, 95% CI:1.13~1.69)和LR(HR=2.09, 95% CI:1.39~3.13)增加有关;相较于切缘距肿瘤超过1 mm,切缘在1 mm以内患者的LR风险亦更高,建议保乳手术应达到至少1 mm的清晰边缘。
因此,鉴于足够干净的阴性切缘是确保MMBC保乳手术安全性的重中之重,建议临床医生参照“1 mm”的切缘宽度标准,并结合临床实际情况,谨慎控制切缘,预留一定的风险缓冲区域。
为充分达到清晰、干净的保乳手术切缘,提高术中切缘评估的精确性成为迫切需求。基于组织生化差异原理的拉曼光谱、基于组织电特性差异原理的MarginProbe等多元化新技术正在开发中。其中MarginProbe 是美国FDA 批准的用于辅助分析保乳手术切缘的唯一设备,临床试验证实其可有效提升保乳手术切缘评估的灵敏度[57]。此外,将术中冰冻切片与细胞学印片相结合,亦可有效降低切缘评估的假阳性率,以避免不必要的二次切除手术[58]。
4.3 MMBC保乳术后外形及生活质量评价
除安全性考虑外,传统观念不支持MMBC保乳手术的理由之一,即认为MMBC存在多处病灶,术中需切除较多组织,使得美容效果大打折扣。但近10年来,已有多篇MMBC保乳手术相关研究达成了可接受的美学结果。Tan等[48]报告显示,仅通过单一切口和局部组织重排对MMBC进行保乳治疗即可获得满意的美容效果:19例MMBC患者均给出3分(满意)或更高的评价,其中52.6%的评价为5分(优秀)。
此外,乳腺肿瘤切除术等传统保乳术无法处理的更小的乳房-肿瘤体积比、更大的切除体积损失等极端病例,均可通过肿瘤整形术应对。Silverstein等[39]报道了2例采用EOBCS治疗并实现出色美学效果的MMBC病例。该团队采取wise pattern术式成功完成1例病灶间隔81 mm的3灶MCBC保乳手术和1例病灶间隔约90 mm的65岁MMBC患者保乳手术,术后双乳均对称、美观。
一项临床研究采用Breast-Q量表报告了MMBC与大型肿瘤等病例接受EOBCS的结局[59]。术后12月时,患者对乳房满意度、结局满意度、心理健康和性健康自我评分分别为(78.0±16.6)分、(85.7±13.7)分、(90.8±11.5)分和(75.8±11.7)分,表明患者呈积极的认知态度;在术后并发症方面,未出现感染、乳头坏死等严重并发症,仅需保守治疗的伤口开裂等轻度并发症发生率为7.7%。
Savioli等[53]亦报告了类似结果,仅4%的MMBC保乳手术患者需再次手术干预。上述研究表明,通过合理评估病灶、联合肿瘤整形技术,MMBC保乳手术有望在实现肿瘤根治的同时,兼顾美观和器官功能,提升患者对于保乳手术的外形满意度。
5 小结与展望
近年来,MMBC相关研究在术前影像学评估、分子标志物与病理特征、外科治疗等多方面均取得了新进展。MMBC术前评估除传统超声、MG外,必要时加入MRI或联合DWI、DCE-MRI,有助于提高诊断的准确性,为手术方案提供更多参考信息。
影像组学如进一步对MMBC特征进行深度挖掘,结合人工智能图像识别技术,将有望成为MMBC早期精准诊断的一大助力。鉴于MMBC病灶之间存在一定的病理异质性,对次要病灶进行充分评估有助于制定个体化治疗决策,并在必要时考虑适当升级治疗手段。
在基础研究方面,结合MMBC灶间异质性和潜在的分子标志物,筛选出潜在的药物靶点,或将推动治疗策略的更新。
在外科治疗方面,笔者认为在达到外形美观和阴性切缘的前提下,采用保乳手术治疗MMBC具有可行性,且契合“最小有效治疗”的外科治疗模式。切缘阴性是制约MMBC保乳手术成败的重要瓶颈,为保证手术安全性,需选择适当的切缘宽度,充分确保切缘阴性。
在美学追求方面,肿瘤整形术可优化MMBC保乳手术的美容结果,新术式如双层旋转法亦不断在MMBC保乳治疗中得到成功实践,为守护健康之美领航。
尽管前瞻性试验ACOSOG Z11102最新结果为MMBC保乳手术提供了强有力的支持,但未来尚需追踪更多高质量证据以论证该治疗策略的安全性。研究者应避开既往研究缺陷,纳入合理的样本、避免选择偏倚、确保长时间随访,尽可能量化潜在的影响因素如乳房-肿瘤体积比、以肿瘤总尺寸评定的T分期、肿瘤所处位置(是否位于内上象限),以期探索出更加理想的MMBC个体化疗法。
参考文献
[1]Masannat Y A, Rocco N, Garreffa E, et al. Global variations in the definition and management of multifocal and multicentric breast cancer: the MINIM international survey[J]. Br J Surg, 2022, 109(8): 656-659.
[2]Winters Z E, Horsnell J, Elvers K T, et al. Systematic review of the impact of breast-conserving surgery on cancer outcomes of multiple ipsilateral breast cancers[J]. BJS Open, 2018, 2(4): 162-174.
[3]Holland R, Veling S H, Mravunac M, et al. Histologic multifocality of Tis, T1-2 breast carcinomas. Implications for clinical trials of breast-conserving surgery[J]. Cancer, 1985, 56(5): 979-990.
[4]Bendifallah S, Werkoff G, Borie-Moutafoff C, et al. Multiple synchronous (multifocal and multicentric) breast cancer: clinical implications[J]. Surg Oncol, 2010, 19(4): e115-e123.
[5]Vera-Badillo F E, Napoleone M, Ocana A, et al. Effect of multifocality and multicentricity on outcome in early stage breast cancer: a systematic review and meta-analysis[J]. Breast Cancer Res Treat, 2014, 146(2): 235-244.
[6]Masannat Y A, Agrawal A, Maraqa L, et al. Multifocal and multicentric breast cancer, is it time to think again?[J]. Ann R Coll Surg Engl, 2020, 102(1): 62-66.
[7]Mariscotti G, Durando M, Tagliafico A, et al. Preoperative breast cancer staging with multi-modality imaging and surgical outcomes[J]. Eur J Radiol, 2020, 122: 108766.
[8]Bozzini A, Renne G, Meneghetti L, et al. Sensitivity of imaging for multifocal-multicentric breast carcinoma[J]. BMC Cancer, 2008, 8: 275.
[9]Lameijer J R, Coolen A M, Nederend J, et al. Frequency and characteristics of additionally detected ipsilateral breast lesions following recall at screening mammography[J]. Breast, 2018, 42: 94-101.
[10]Krammer J, Stepniewski K, Kaiser C G, et al. Value of additional digital breast tomosynthesis for preoperative staging of breast cancer in dense breasts[J]. Anticancer Res, 2017, 37(9): 5255-5261.
[11]Mariscotti G, Houssami N, Durando M, et al. Accuracy of mammography, digital breast tomosynthesis, ultrasound and MR imaging in preoperative assessment of breast cancer[J]. Anticancer Res, 2014, 34(3): 1219-1225.
[12]Mercier J, Kwiatkowski F, Abrial C, et al. The role of tomosynthesis in breast cancer staging in 75 patients[J]. Diagn Interv Imaging, 2015, 96(1): 27-35.
[13]Lorek A, Steinhof-Radwańska K, Barczyk-Gutkowska A, et al. The usefulness of spectral mammography in surgical planning of breast cancer treatment-analysis of 999 patients with primary operable breast cancer[J]. Curr Oncol, 2021, 28(4): 2548-2559.
[14]Lee S C, Hovanessian-Larsen L, Stahl D, et al. Accuracy of contrast-enhanced spectral mammography compared with MRI for invasive breast cancers: prospective study in population of predominantly underrepresented minorities[J]. Clin Imaging, 2021, 80: 364-370.
[15]Maskarinec G, Meng L, Ursin G. Ethnic differences in mammographic densities[J]. Int J Epidemiol, 2001, 30(5): 959-965.
[16]周星彤, 沈松杰, 孙强. 中国乳腺癌筛查现状及进展[J]. 中国医学前沿杂志(电子版), 2020, 12(3): 6-11.
[17]Rehman S, Niazi I K, Naveed M A, et al. Sonographic evaluation of incidental synchronous masses in patients with breast cancer: clinical significance and diagnostic workup[J]. Eur J Breast Health, 2021, 17(1): 28-35.
[18]Moon W K, Noh D Y, Im J G. Multifocal, multicentric, and contralateral breast cancers: bilateral whole-breast US in the preoperative evaluation of patients[J]. Radiology, 2002, 224(2): 569-576.
[19]Sriussadaporn S, Sriussadaporn S, Pak-Art R, et al. Ultrasonography increases sensitivity of mammography for diagnosis of multifocal, multicentric breast cancer using 356 whole breast histopathology as a gold standard[J]. Surg Pract, 2022, 26(3): 181-186.
[20]Helal M, Mansour S, Khaled R, et al. The role of automated breast ultrasound in the assessment of the local extent of breast cancer[J]. Breast J, 2021, 27(2): 113-119.
[21]Gilbert F J, Pinker-Domenig K. Diagnosis and staging of breast cancer: when and how to use mammography, tomosynthesis, ultrasound, contrast-enhanced mammography, and magnetic resonance imaging[M]//Hodler J, Kubik-Huch R A, Von Schulthess G K. Diseases of the Chest, Breast, Heart and Vessels 2019—2022. Cham: Springer, 2019: 155-166.
[22]Houssami N, Ciatto S, Macaskill P, et al. Accuracy and surgical impact of magnetic resonance imaging in breast cancer staging: systematic review and meta-analysis in detection of multifocal and multicentric cancer[J]. J Clin Oncol, 2008, 26(19): 3248-3258.
[23]Rabasco P, Caivano R, Dinardo G, et al. Magnetic resonance imaging in the pre-surgical staging of breast cancer: our experience[J]. Cancer Invest, 2017, 35(1): 43-50.
[24]Song S E, Park E K, Cho K R, et al. Additional value of diffusion-weighted imaging to evaluate multifocal and multicentric breast cancer detected using pre-operative breast MRI[J]. Eur Radiol, 2017, 27(11): 4819-4827.
[25]Janeva S, Krabbe E, Parris T Z, et al. Clinical evaluation of molecular surrogate subtypes in patients with ipsilateral multifocal primary breast cancer[J]. Breast Cancer Res, 2023, 25(1): 36.
[26]Dal F, Ökmen H, Ulusan K, et al. Does focal heterogeneity affect survival in postoperative ipsilateral multifocal and multicentric breast cancers?[J]. Rev Assoc Med Bras (1992), 2022, 68(3): 405-412.
[27]Li S, Wu J Y, Huang O, et al. Association of molecular biomarker heterogeneity with treatment pattern and disease outcomes in multifocal or multicentric breast cancer[J]. Front Oncol, 2022, 12: 833093.
[28]Tong Y, Sun F X, Zhang C P, et al. Multifocal/multicentric breast cancer: Does each focus matter?[J]. Cancer Med, 2023, 12(7): 8815-8824.
[29]Buggi F, Folli S, Curcio A, et al. Multicentric/multifocal breast cancer with a single histotype: is the biological characterization of all individual foci justified?[J]. Ann Oncol, 2012, 23(8): 2042-2046.
[30]Toole M J, Kidwell K M, Van Poznak C. Oncotype dx results in multiple primary breast cancers[J]. Breast Cancer (Auckl), 2014, 8: 1-6.
[31]Lang Z Q, Wu Y Q, Pan X B, et al. Study of differential gene expression between invasive multifocal/ multicentric and unifocal breast cancer[J]. J BUON, 2018, 23(1): 134-142.
[32]Lang Z Q, Wu Y Q, Pan X B, et al. The identification of multifocal breast cancer-associated long non-coding RNAs[J]. Eur Rev Med Pharmacol Sci, 2017, 21(24): 5648-5654.
[33]Zehni A Z, Batz F, Vattai A, et al. The prognostic impact of retinoid X receptor and thyroid hormone receptor alpha in unifocal vs. multifocal/multicentric breast cancer[J]. Int J Mol Sci, 2021, 22(2): 957.
[34]Zati Zehni A, Jacob S N, Mumm J N, et al. Hormone receptor expression in multicentric/multifocal versus unifocal breast cancer: especially the VDR determines the outcome related to focality[J]. Int J Mol Sci, 2019, 20(22): 5740.
[35]Houvenaeghel G, Tallet A, Jalaguier-Coudray A, et al. Is breast conservative surgery a reasonable option in multifocal or multicentric tumors?[J]. World J Clin Oncol, 2016, 7(2): 234-242.
[36]Patani N, Carpenter R. Oncological and aesthetic considerations of conservational surgery for multifocal/multicentric breast cancer[J]. Breast J, 2010, 16(3): 222-232.
[37]Fang M, Zhang A A, Zhang H, et al. Local control of breast conservation therapy versus mastectomy in multifocal or multicentric breast cancer: a systematic review and meta-analysis[J]. Breast Care (Basel), 2019, 14(4): 188-193.
[38]Shaikh T, Tam T Y, Li T Y, et al. Multifocal and multicentric breast cancer is associated with increased local recurrence regardless of surgery type[J]. Breast J, 2015, 21(2): 121-126.
[39]Silverstein M J, Savalia N, Khan S, et al. Extreme oncoplasty: breast conservation for patients who need mastectomy[J]. Breast J, 2015, 21(1): 52-59.
[40]Curigliano G, Burstein H J, Winer E P, et al. De-escalating and escalating treatments for early-stage breast cancer: the St. Gallen International Expert Consensus Conference on the Primary Therapy of Early Breast Cancer 2017[J]. Ann Oncol, 2017, 28(8): 1700-1712.
[41]Gradishar W J, Moran M S, Abraham J, et al. Breast cancer, version 3.2022, NCCN clinical practice guidelines in oncology[J]. J Natl Compr Canc Netw, 2022, 20(6): 691-722.
[42]Hartsell W F, Recine D C, Griem K L, et al. Should multicentric disease be an absolute contraindication to the use of breast-conserving therapy?[J]. Int J Radiat Oncol Biol Phys, 1994, 30(1): 49-53.
[43]Gentilini O, Botteri E, Rotmensz N, et al. Conservative surgery in patients with multifocal/multicentric breast cancer[J]. Breast Cancer Res Treat, 2009, 113(3): 577-583.
[44]Leopold K A, Recht A, Schnitt S J, et al. Results of conservative surgery and radiation therapy for multiple synchronous cancers of one breast[J]. Int J Radiat Oncol Biol Phys, 1989, 16(1): 11-16.
[45]Kurtz J M, Jacquemier J, Amalric R, et al. Breast-conserving therapy for macroscopically multiple cancers[J]. Ann Surg, 1990, 212(1): 38-44.
[46]Okumura S, Mitsumori M, Yamauchi C, et al. Feasibility of breast-conserving therapy for macroscopically multiple ipsilateral breast cancer[J]. Int J Radiat Oncol Biol Phys, 2004, 59(1): 146-151.
[47]Lim W, Park E H, Choi S L, et al. Breast conserving surgery for multifocal breast cancer[J]. Ann Surg, 2009, 249(1): 87-90.
[48]Tan M P, Sitoh N Y, Sitoh Y Y. Optimising breast conservation treatment for multifocal and multicentric breast cancer: a worthwhile endeavour?[J]. World J Surg, 2016, 40(2): 315-322.
[49]Nos C, Bourgeois D, Darles C, et al. Conservative treatment of multifocal breast cancer: a comparative study[J]. Bull Cancer, 1999, 86(2): 184-188.
[50]Kaplan J, Giron G, Tartter P I, et al. Breast conservation in patients with multiple ipsilateral synchronous cancers[J]. J Am Coll Surg, 2003, 197(5): 726-729.
[51]Kadioglu H, Yücel S, Yildiz S, et al. Feasibility of breast conserving surgery in multifocal breast cancers[J]. Am J Surg, 2014, 208(3): 457-464.
[52]Crown A, Laskin R, Rocha F G, et al. Extreme oncoplasty: expanding indications for breast conservation[J]. Am J Surg, 2019, 217(5): 851-856.
[53]Savioli F, Seth S, Morrow E, et al. Extreme oncoplasty: breast conservation in patients with large, multifocal, and multicentric breast cancer[J]. Breast Cancer (Dove Med Press), 2021, 13: 353-359.
[54]De Lorenzi F, Borelli F, Pagan E, et al. Oncoplastic breast-conserving surgery for synchronous multicentric and multifocal tumors: is it oncologically safe? A retrospective matched-cohort analysis[J]. Ann Surg Oncol, 2022, 29(1): 427-436.
[55]Boughey J C, Rosenkranz K M, Ballman K V, et al. Local recurrence after breast-conserving therapy in patients with multiple ipsilateral breast cancer: results from ACOSOG Z11102 (Alliance)[J]. J Clin Oncol, 2023, 41(17): 3184-3193.
[56]Bundred J R, Michael S, Stuart B, et al. Margin status and survival outcomes after breast cancer conservation surgery: prospectively registered systematic review and meta-analysis[J]. BMJ, 2022, 378: e070346.
[57]Schnabel F, Boolbol S K, Gittleman M, et al. A randomized prospective study of lumpectomy margin assessment with use of MarginProbe in patients with nonpalpable breast malignancies[J]. Ann Surg Oncol, 2014, 21(5): 1589-1595.
[58]Tamanuki T, Namura M, Aoyagi T, et al. Effect of intraoperative imprint cytology followed by frozen p on margin assessment in breast-conserving surgery[J]. Ann Surg Oncol, 2021, 28(3): 1338-1346.
[59]Koppiker C B, Noor A U, Dixit S, et al. Extreme oncoplastic surgery for multifocal/multicentric and locally advanced breast cancer[J]. Int J Breast Cancer, 2019, 2019: 4262589.
周晓燕教授点评 | 乳腺癌BRCA基因检测面面观:从适用人群到检测方法,从样本类型到报告解读
![]() 0
2024-07-11
点击查看
0
2024-07-11
点击查看
广西医科大学宁峙彭教授等团队合作IJS:发现他汀类药物联合紫杉醇改善乳腺癌预后新策略
![]() 0
2024-07-08
点击查看
0
2024-07-08
点击查看
Ann. Oncol :MONARCH 3试验:阿贝西利联合非甾体类芳香酶抑制剂改善HR+/HER2-晚期乳腺癌总生存
![]() 0
2024-07-13
点击查看
0
2024-07-13
点击查看

Arthritis Care Res:类风湿关节炎患者乳腺癌确诊后生物病情缓解抗风湿药物(bDMARDs)的使用比例会变化吗?
![]() 0
2024-07-17
点击查看
0
2024-07-17
点击查看
【论著】| SIRT3通过去乙酰化YME1L1诱导乳腺癌内分泌治疗耐药的作用机制研究
![]() 0
2024-07-20
点击查看
0
2024-07-20
点击查看
【协和医学杂志】新型[18F]-FES PET/CT无创功能性诊断乳腺癌迟发性肺转移致霍纳综合征一例
![]() 0
2024-07-22
点击查看
0
2024-07-22
点击查看
