鉴于特异性KRAS G12D抑制剂的临床开发正在进行中,研究者试图研究KRAS G12D突变肺腺癌患者的临床病理特征、共存基因组特征和生存结局。2008至2020年间,3828例完全切除的原发性肺腺癌患者接受了KRAS突变检测。
在65例(1.7%)肺腺癌患者检出KRAS G12D突变。KRAS G12D突变在男性、既往/当前吸烟者、影像学实体瘤和浸润性黏液腺癌(IMA)中更常见。TP53和STK11是KRAS G12D组中最常见的两个伴随突变。KRAS G12D突变似乎不是切除的I-III期肺腺癌的预后因素,而KRAS非G12D突变与较差的生存相关,尤其是在I期肿瘤中。与PD-L1表达阴性(<1%)相比,KRAS G12D突变与PD-L1表达阳性但低(1-49%)相关,而KRAS非G12D突变与PD-L1表达高(≥50%)相关。TP53共突变提示PD-L1表达较高,而STK11共突变对PD-L1表达的影响非常小。此外,对来自cBioPortal的MSK数据库进行的数据挖掘显示,KRAS G12D和SKT11共突变与免疫治疗反应降低相关。
KRAS G12D突变肺腺癌具有独特的临床病理特征和基因组特征。尽管KRAS G12D对切除的肺腺癌并无预后意义,但与某些共同突变相结合,KRAS G12D可能是一种有价值的生物标志物,可用于识别最终可能影响治疗方案的相关患者亚组。
KRAS G12D突变与早期可切除肺腺癌的预后无关;
KRAS G12D与更多的IMA、阳性但低PD-L1 TPS和低TMB相关;
KRAS G12D+STK11突变可能是免疫治疗的强负相关生物标志物。
研究背景
肺癌是全球癌症相关死亡的主要原因。非小细胞肺癌(NSCLC)是最常见的肺部恶性肿瘤。近年来,NSCLC(尤其是腺癌)的致癌驱动基因已被确定,许多具有显著临床获益的靶向药物已被开发出来。KRAS基因突变是NSCLC患者中最常见的致癌驱动基因之一。KRAS基因编码的致癌蛋白在促进肿瘤生长和分化的信号通路中发挥关键作用。
最常见的3种KRAS突变是G12C、G12V和G12D。然而,KRAS突变在NSCLC患者中的预后价值仍存在争议。这些不一致的结果可以归因于KRAS的异质性。不同的KRAS突变可能影响特定癌症的生物学和基因组特征,可能具有重大的治疗意义。突变的KRAS蛋白长期以来被认为是“不可用药”的。尽管特异性KRAS G12C等位基因抑制剂正在临床开发中,但许多KRAS突变癌症仍然缺乏有效的治疗方法。KRAS G12D抑制剂目前在临床前研究中显示出良好的疗效,有望很快进入临床试验。然而,对于KRAS G12D突变NSCLC患者的特征,尤其是在早期切除的肺癌患者中,了解相对较少。迫切需要更好地了解KRAS G12D突变肿瘤的临床和基因组特征。本研究探讨了该中心KRAS G12D突变患者的临床病理特征、共存基因组特征及预后。
研究方法
研究收集了2008年1月至2020年12月复旦大学附属肿瘤医院胸外科手术切除的肺腺癌标本。接受新辅助化疗的患者被排除。所有患者手术完整切除后切缘均为阴性。PD-L1表达的肿瘤比例评分(TPS)定义为PD-L1染色阳性的肿瘤细胞占所有肿瘤细胞的百分比。PD-L1表达进一步分为无表达(TPS<1%)、低表达(TPS:1-49%)和高表达(TPS≥50%)。
研究结果
KRAS G12D突变患者的特征:
在3829例患者中,有65例(1.7%)发现KRAS G12D突变,仅次于G12C亚型(图1B)。KRAS G12D突变患者以男性(72.3%)和既往/当前吸烟者(53.8%)为主。与KRAS野生型相比,KRAS G12D与影像学实体瘤(73.8% vs. 52.9%,p=0.01)和浸润性黏液腺癌(26.2% vs. 2.3%,p<0.001)显著相关(表1)。与KRAS非G12D组相比,KRAS G12D组Ki-67表达较低(低,<20%;高,≥20%)。其他临床病理特征见表1。关于KRAS密码子亚型的详细信息见图1B。
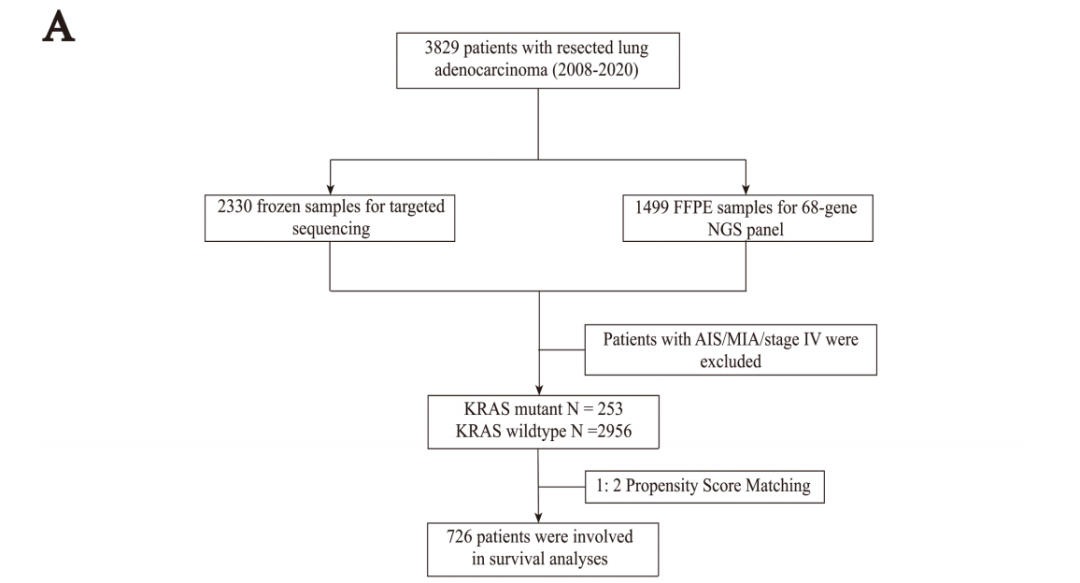
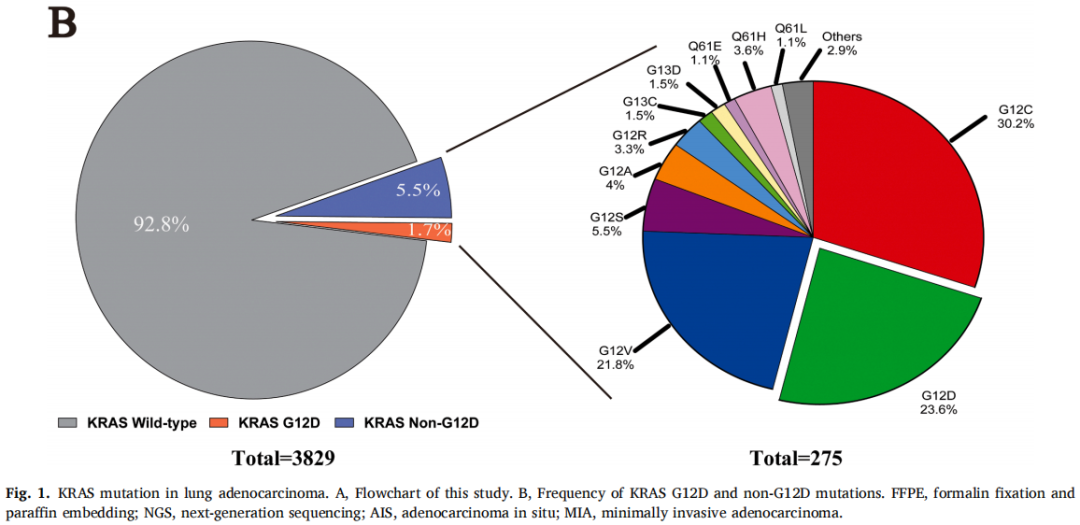
图1
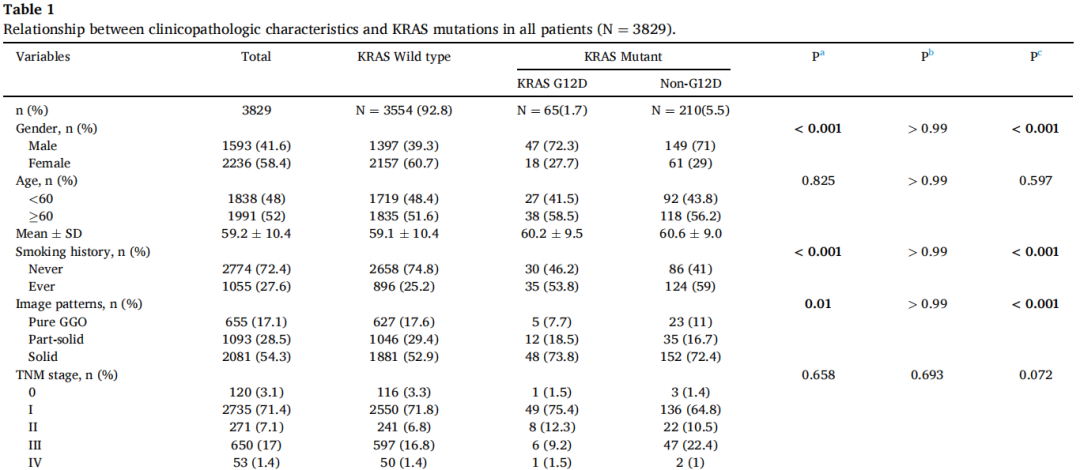
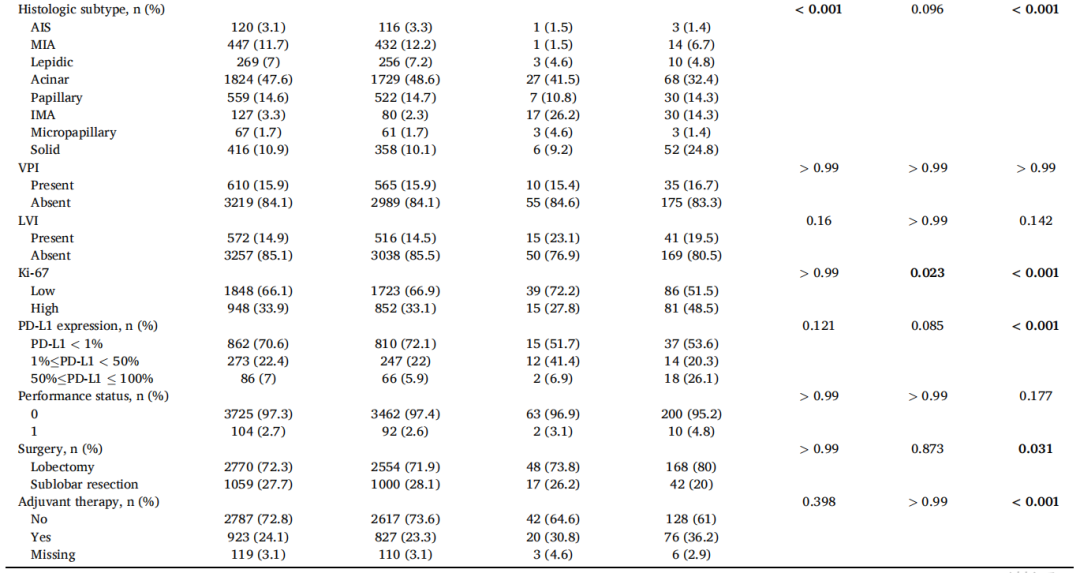
表1
本研究展示了KRAS G12D突变肿瘤中最常见的几种共突变。在KRAS G12D突变组中,TP53、STK11、ATM、PIK3CA和TSC2共突变频率较高,而只有STK11共突变的频率存在显著差异(P<0.001)。KRAS非G12D组的RET和KIT共突变显著超过野生型组。
KRAS G12D患者的生存分析和复发模式:
所有患者的中位随访时间为31个月。原位腺癌/微浸润腺癌患者因生存良好而被排除出生存分析。IV期疾病患者也被排除。PSM(倾向得分匹配)后,根据相关参数,两组在基线时进行了良好匹配,726例患者被纳入生存分析(图1A)。57例携带KRAS G12D突变的患者被纳入生存分析。KRAS G12D突变型与野生型患者的生存差异无统计学意义。然而,与野生型患者相比,KRAS非G12D突变患者的DFS(无病生存期)更差(P=.048)(图2)。此外,KRAS非G12D突变组在I期患者中有更差的DFS(P=.006)和OS(总生存期,P=.06),但在II和III期患者中没有。

图2
研究者通过Cox比例风险模型进一步研究了KRAS G12D突变的预后意义。首先,研究者分析了参与生存分析的所有患者的DFS和OS,发现KRAS G12D突变不是独立预后因素。分层分析显示,KRAS非G12D突变是DFS的独立预测因素(HR,2.14;95%CI,1.33-3.42;P=.002)。
多变量logistic分析表明,KRAS G12D突变与特定复发部位不相关。术后1年内为早期复发,术后1年以上为晚期复发。多变量分析显示,KRAS非G12D突变与早期复发相关(P=0.012),而G12D与其无关。
KRAS G12D和PD-L1表达:
基线时,队列中1221例(31.9%)患者接受了PD-L1检测(表1)。其中1108例患者也有可获得的共突变数据。28例有共突变数据的KRAS G12D突变患者接受了PD-L1水平评估。由于PD-L1表达升高与免疫治疗的反应强正相关,因此研究者感兴趣的是识别KRAS突变亚型和同时存在的突变如何与PD-L1表达阳性(TPS≥1%)相关,特别是相对于无表达的PD-L1表达水平低和高。
STK11野生型和突变型组之间的PD-L1表达相似,但在KRAS或TP53突变型肿瘤中,PD-L1表达显著高于野生型(图3A)。KRAS非G12D的上四分位PD-L1 TPS为60%,其次是KRAS G12D(18%)和野生型(1%)(图3B)。KRAS非G12D/TP53共突变亚组的PD-L1表达高于KRAS非G12D/TP53wt或KRAS G12D/TP53wt(均P<.05),而STK11共突变对KRAS突变肿瘤的PD-L1表达无显著影响(图3C和D)。多变量logistic回归显示,KRAS G12D突变与PD-L1阳性但低表达(1-49%)相关,而KRAS非G12D或TP53突变与PD-L1高表达(≥50%)相关(表2)。
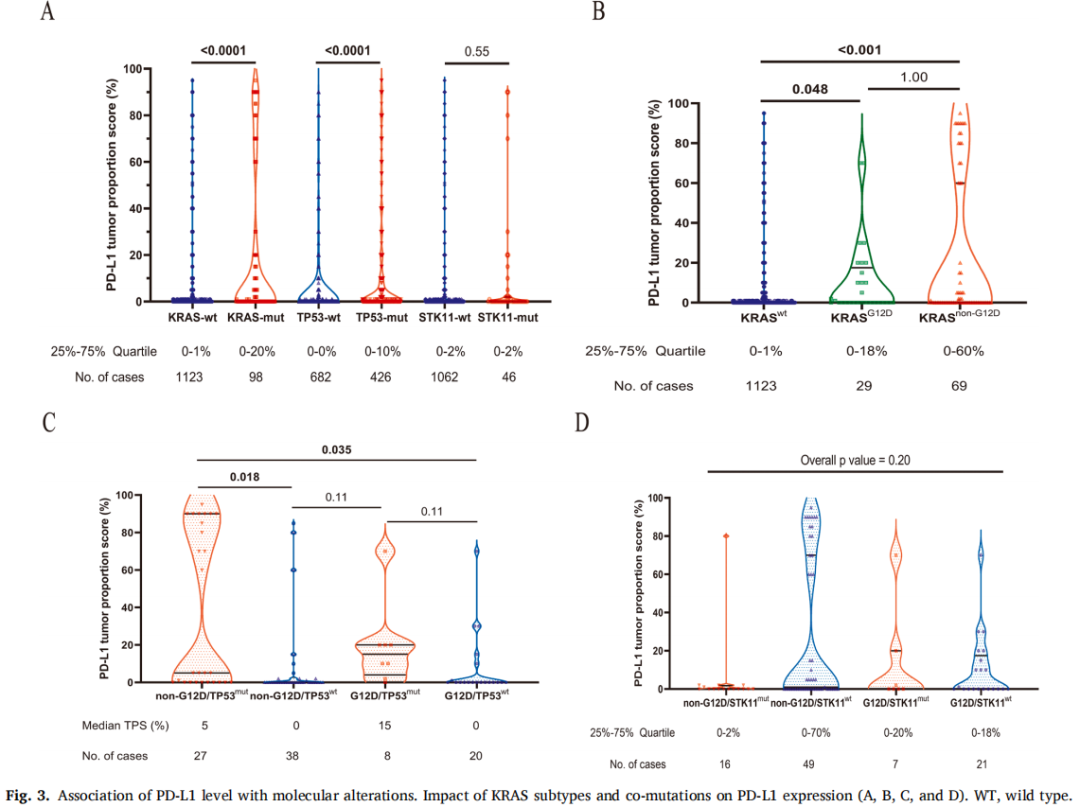
图3
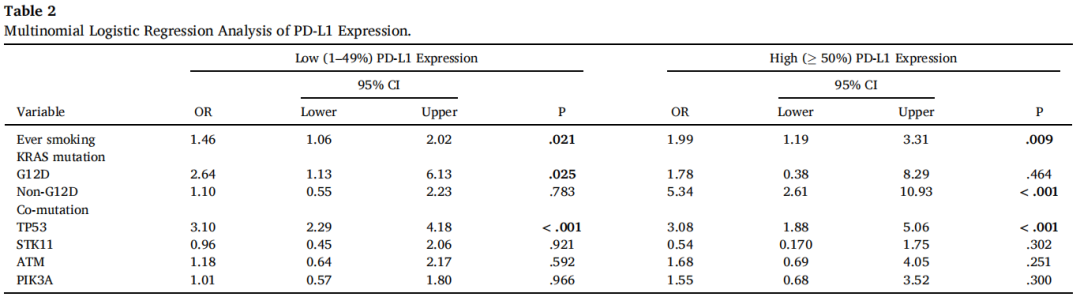
表2
KRAS G12D和免疫治疗:
为了进一步扩展研究发现的PD-L1表达和KRAS G12D之间的关联,研究者查询了来自cBioPortal的两个MSK数据库(MSK Impact和MSK TMB)中接受免疫治疗的病理性肺腺癌患者。首先,研究者探讨了KRAS亚型和某些共突变对肿瘤突变负荷(TMB)的影响,TMB是另一个重要的免疫治疗生物标志物。值得注意的是,研究者发现在KRAS mut、TP53 mut和STK11 mut肿瘤中,中位TMB显著较高。KRAS非G12D的中位TMB为9,其次是KRAS野生型(中位数:6)和KRAS G12D(中位数:5)。通过多重比较,TP53共突变与KRAS突变肿瘤的TMB增加相关,而STK11共突变未显著影响KRAS突变肿瘤的TMB。
接下来,研究者分析了KRAS亚型和常见共突变对免疫治疗疗效的影响。KRAS G12D突变患者的中位PFS(1.8个月)和OS(6个月)均低于KRAS非G12D突变患者(中位PFS=4.3个月;中位OS=13个月)或KRAS野生型(中位PFS=3.3个月;中位OS=12个月),但无统计学显著性。与KRAS G12D+STK11wt(1.9个月)、KRAS非G12D+STK11wt(4.4个月)和KRAS非G12D+STK11mut(2.5个月)相比,KRAS G12D+ STK11mut患者的中位PFS最短(1.7个月)。KRAS G12D+STK11mut也显示出显著较短的OS(中位OS=6个月)(图4B和D)。在KRAS G12D亚组中,TP53共突变不影响免疫治疗预后,而KRAS非G12D+TP53mut显示了较长的中位PFS(7.2个月)(图4A和C)。

图4
讨 论
近年来,随着KRAS G12D抑制剂的发展,有必要对手术切除的KRAS G12D突变型肿瘤患者的特征和预后进行分析。本文介绍了KRAS G12D突变型腺癌的临床病理、分子和生存数据。KRAS G12D突变在男性、当前/既往吸烟者、浸润性黏液腺癌和影像学实体瘤中更常见。KRAS G12D突变型肿瘤的Ki-67和PD-L1表达低于非G12D突变型肿瘤。据报道,TP53(27.3%)和STK11(24.2%)是最常见的两种共发生突变。
先前的研究发现KRAS突变与各期患者生存率下降之间存在关联。很少有研究关注KRAS G12D突变患者,特别是在切除的早期肺腺癌患者中。最近的一项荟萃分析发现,在KRAS亚型中,G12V基因型可能预测手术切除的早期NSCLC患者的不良结局。在本研究的生存分析中,KRAS G12D突变与预后无关。进一步分层分析显示,KRAS非G12D亚型与I期肿瘤的不良生存结局相关,而G12D亚型与其无关。
术后复发与不良预后相关,并影响随访策略。早期的研究表明KRAS突变与早期复发相关。在本研究中,非G12D KRAS突变与早期复发密切相关,而G12D突变与早期复发无关。KRAS G12D突变与复发部位之间的关系也不清楚。Renaud等人发现KRAS G12C/V分别与骨和胸膜-心包转移相关。Ricciuti等人发现KRAS G12D肺癌比KRAS非G12D肺癌更易发生肺转移。研究者发现KRAS G12D并未增加局部区域或远处复发。匹配后,KRAS非G12D与局部区域和远处复发风险增加相关。
免疫治疗,尤其是免疫检查点抑制剂(ICIs)已经进入了肺癌治疗的历史。ICIs也越来越多地用于早期恶性肿瘤的新辅助和辅助治疗。除了PD-L1和TMB等生物标志物,目前正在对常见肿瘤驱动基因与免疫治疗之间的关系进行进一步研究。研究者发现KRAS突变型肿瘤的PD-L1表达和TMB显著高于野生型肿瘤。更重要的是,KRAS亚型影响肿瘤PD-L1表达和TMB。虽然既往研究表明KRAS突变可能是ICIs获益的生物标志物,但基于MSK数据库研究者发现,KRAS G12D突变患者接受ICIs治疗后的结局劣于KRAS非G12D突变患者,这表明并非所有KRAS突变具有相同的预测效果。
在KRAS突变的肺癌中,STK11、KEAP1和TP53等共突变与不同的生物学和治疗敏感性相关。在本研究中,TP53突变与PD-L1高表达相关,而STK11共突变与PD-L1高表达无关。在免疫治疗数据库中,KRAS G12D与STK11突变共存在与不良结局相关。相反,KRAS非G12D和TP53共突变患者的PFS较长。大量研究表明,在接受免疫治疗的肺癌患者中,KRAS和STK11/TP53共突变与不同的预后相关。研究者进一步根据KRAS亚型对患者进行分层,发现KRAS G12D+STK11mut和KRAS非G12D+TP53mut可能是肺腺癌免疫治疗有价值的生物标志物。
本研究的一个局限性是KRAS G12D组样本量小,原因是亚洲NSCLC患者中KRAS G12D突变的患病率低(1.6%-3.1%),这阻碍了分层分析的可能性。几十个基因panel的共突变数据不足且不成熟是另一个局限性。研究者期待在未来的研究设计中检测出更具有潜在预测性和预后性的生物标志物。此外,由于临床分期的精确度对于得出进一步的普遍结论很重要,因此,关于特定术前扫描(如PET/CT)的详细信息不完整可能会引入偏倚并限制本研究中的额外分析。
KRAS G12D突变型肺腺癌具有独特的临床病理特征和基因组学特征。尽管KRAS G12D对切除的肺腺癌无预后意义,但与某些基因(如STK11)共突变可能是有价值的生物标志物,有助于识别最终可能影响治疗方案的相关患者亚组。
参考文献:
Cao, Hang et al. “Clinicopathologic features, concurrent genomic alterations, and clinical outcomes of patients with KRAS G12D mutations in resected lung adenocarcinoma.” European journal of cancer (Oxford, England : 1990), vol. 202 113985. 2 Mar. 2024, doi:10.1016/j.ejca.2024.113985

肿瘤科:浸润性肺腺癌病理学分级(IASLC分级)
![]() 0
2024-03-05
点击查看
0
2024-03-05
点击查看
Cell子刊:李汉杰/陈昶/王光锁/陈云揭示了独立依赖的三级淋巴结构的抗肿瘤作用
![]() 0
2024-03-10
点击查看
0
2024-03-10
点击查看

论文解读|Gen Li / Kang Zhang / Xun Hu教授团队发现新型免疫相关特征可用于肺癌复发预测
![]() 0
2024-03-18
点击查看
0
2024-03-18
点击查看

问诊分析:混合磨玻璃肺癌病理低分化,术后才3个月又现实性结节,转移了吗?
![]() 0
2024-03-28
点击查看
0
2024-03-28
点击查看

Cell子刊:四川大学刘伦旭等团队合作发现多细胞生态型影响肺腺癌从磨玻璃样变到晚期的进展
![]() 0
2024-04-02
点击查看
0
2024-04-02
点击查看

Genes&Diseases:尚沛研究员团队基于机器学习算法和单细胞分析揭示肺腺癌中MAPK 通路共表达的生物标记物及其功能
![]() 0
2024-04-07
点击查看
0
2024-04-07
点击查看
