沈阳药科大学ACS Nano:双靶向自佐剂杂环杂化纳米疫苗可大幅改善癌症免疫治疗效果
2024-06-08 BioMed科技 BioMed科技 发表于上海
沈阳药科大学Xing Tang、苟靖欣副教授和杨丽教授等人提出了引流淋巴结靶向和肿瘤靶向的纳米疫苗策略来解决这些限制,并合成了杂环脂质和聚酯以实现癌症双重靶向免疫疗法。
目前,肿瘤疫苗只显示出适度的应答率,这主要是归因于其向树突状细胞(DC)的递送、交叉呈递效率较低,同时DC固有免疫抑制信号和免疫抑制肿瘤微环境(TME)也造成了疫苗的效果较差。
在本研究中,沈阳药科大学Xing Tang、苟靖欣副教授和杨丽教授等人提出了引流淋巴结(DLN)靶向和肿瘤靶向的纳米疫苗策略来解决这些限制,并合成了杂环脂质(lipidoid)(A18)和聚酯(BR647)以实现癌症双重靶向免疫疗法。纳米疫苗旨在靶向DLN和肿瘤,促进货物输送到细胞质中。这些双靶向纳米疫苗可改善抗原呈递和DC成熟,激活了干扰素基因刺激因子(STING)通路,增强了促凋亡作用,并刺激了抗肿瘤免疫反应。此外,这些双靶向纳米疫苗克服了免疫抑制性TME,减少了免疫抑制细胞,并促进了肿瘤相关中性粒细胞从N2向N1的极化。在四种可诱导强大抗肿瘤反应的双靶向纳米疫苗中,杂环lipidoid@polyester杂化纳米疫苗(MALO@HBNS)展现出了最优异的结果。这项工作介绍了一种用于抗肿瘤治疗的双靶向纳米疫苗平台,其与免疫检查点阻断剂的潜在组合有望成为一种全面的抗癌策略。相关工作以“Dual-Targeted Self-Adjuvant Heterocyclic Lipidoid@Polyester Hybrid Nanovaccines for Boosting Cancer Immunotherapy”为题发表在ACS Nano。

【文章要点】
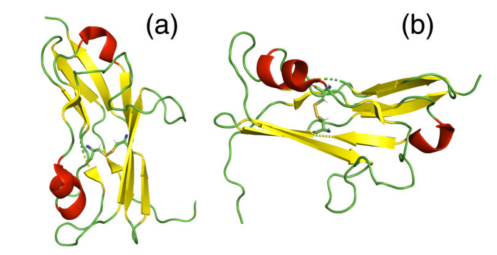
信号转导和转录激活因子3(STAT3)参与各种生物功能,其过度激活与加速肿瘤进展和上调肿瘤免疫抑制细胞[如调节性T细胞(Tregs)和髓源性抑制细胞[MDSCs)]有关,可促进肿瘤免疫逃逸。此外,STAT3还可抑制DC的成熟。作者团队之前的研究提供了一种将STAT3 siRNA和卵清蛋白肽257–264(OVA)结合以增强癌症免疫治疗的策略,STAT3 siRNA可与OVA协同作用,促进DC成熟,提高抗原提呈能力,消除免疫抑制(Chemical Engineering Journal 2023, 475, 146474)。因此,在这项工作中,作者引入了一种将STAT3 siRNA与疫苗相结合的策略。在该策略中,作者合成了杂环脂质(A18)和聚酯(BR647),以实现癌症的DLN和肿瘤双重靶向免疫治疗。此外,作者还将寡聚HA和DMG-PEG2000-甘露糖掺入以制备包封OVA和STAT3-siRNA的双靶向纳米疫苗(图1)。

图1 纳米疫苗
根据上述方法,作者制备并研究了四种双靶向纳米疫苗。这些纳米疫苗可靶向DLN和肿瘤,并通过促进内/溶酶体逃逸将货物输送到肿瘤细胞和DC的细胞质中。此外,它们改善了抗原呈递和DC成熟情况,沉默了STAT3基因,激活了STING通路,增强了促凋亡作用,并增加了抗肿瘤免疫反应。因此,纳米疫苗有效减轻了免疫抑制性TME,下调了免疫抑制细胞(如MDSCs和Tregs),靶向中性粒细胞,并促进了肿瘤相关中性粒细胞(TAN)从N2向N1的极化,共同推进癌症免疫治疗(图2)。

图2 抗肿瘤治疗示意图
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c00392
本网站所有内容来源注明为“williamhill asia 医学”或“MedSci原创”的文字、图片和音视频资料,版权均属于williamhill asia 医学所有。非经授权,任何媒体、网站或个人不得转载,授权转载时须注明来源为“williamhill asia 医学”。其它来源的文章系转载文章,或“williamhill asia 号”自媒体发布的文章,仅系出于传递更多信息之目的,本站仅负责审核内容合规,其内容不代表本站立场,本站不负责内容的准确性和版权。如果存在侵权、或不希望被转载的媒体或个人可与我们联系,我们将立即进行删除处理。
在此留言
















#癌症免疫治疗# #纳米疫苗#
26